Учебно-исследовательская работа «Количественное определение сульфатов в воде и почвенной вытяжке»
Цель работы: изучение сульфатов как естественных компонентов воды и почвы с использованием метода их количественного определения.
Вступительная информация
Сульфаты широко присутствуют во всех поверхностных водах. Главными источниками сульфатов в поверхностных водах являются процессы химического выветривания и растворения серосодержащих минералов, в основном гипса, а также окисления сульфидов и серы:
Ионная форма SO42- характерна только для маломинерализованных вод. При увеличении минерализации сульфатные ионы склонны к образованию устойчивых ассоциированных нейтральных пар типа CaSO4, MgSO4.
Концентрация сульфата в природной воде изменяется в широких пределах. В речных водах и в водах пресных озер содержание сульфатов часто колеблется от 5-10 до 60 мг/дм3, в дождевых водах – от 1 до 10 мг/дм3. В подземных водах содержание сульфатов может достигать значительно больших величин.
Концентрация сульфатов в поверхностных водах подвержена заметным сезонным колебаниям и обычно коррелирует с изменением общей минерализации воды. Заметное влияние оказывают окислительно-восстановительные процессы, биологическая обстановка в водном объекте и хозяйственная деятельность человека.
Повышенное содержание сульфатов ухудшает органолептические свойства воды и оказывает физиологическое воздействие на организм человека. ПДК сульфатов в воде водоемов хозяйственно-питьевого назначения составляет 500 мг/дм3, лимитирующий показатель вредности – органолептический.
Данная работа выполняется с помощью производимого ГК «Крисмас» тест-комплекта «Сульфаты» (далее – ТК «Сульфаты»).
 ТК «Сульфаты» предназначен для определения массовой концентрации сульфатов в воде. Метод определения: титриметрический.
ТК «Сульфаты» предназначен для определения массовой концентрации сульфатов в воде. Метод определения: титриметрический.
Тест-комплект представляет собой удобный для переноски, транспортирования и хранения жесткий корпус-укладку, в который компактно размещены необходимые средства измерения, готовые растворы и реагенты, посуда и оборудование, документация.
Тест-комплект «Сульфаты» максимально прост и удобен в использовании, успешно используется при выполнении проектных и учебно-исследовательских работ в курсах химии, биологии, факультативно в экологии, а также в специализированных образовательных организациях при изучении методов и средств водно-химического анализа.
Основное оборудование из состава ТК «Сульфаты»:
Подробнее с алгоритмом приготовления почвенной вытяжки см. в работе 16 в изданном ГК «Крисмас» «Экологическом практикуме: Учебном пособии с комплектом карт-инструкций» / Под ред. к.х.н. А.Г. Муравьёва. – Изд. 7-е, перераб. – СПб.: Крисмас+, 2020. – 176 с.: ил.
Примечание. Экологический практикум входит в состав многих изделий, производимых и поставляемых ГК «Крисмас» – например, в класс-комплект-лабораторию ЭХБ, а также поставляется ГК «Крисмас» по отдельному заказу.
Ход работы
1.
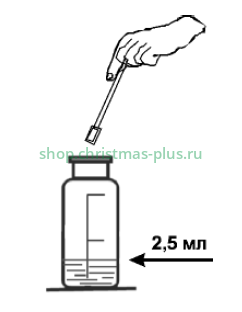
Ополосните калиброванную мерную склянку несколько раз анализируемой водой. Поместите в склянку 2,5 мл пробы воды и, используя мерную ложку, внесите примерно 0,2 г катионита (0,2 г катионита помещается в мерной ложке без горки).
2.
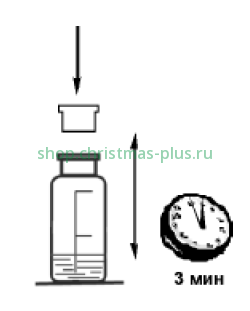
Закройте склянку пробкой. Содержимое склянки встряхивайте в течение 3 мин.
3.
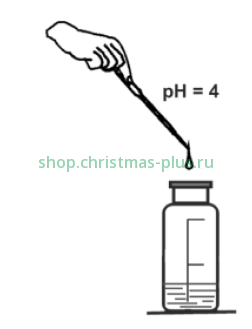
Доведите рН пробы по универсальной индикаторной бумаге до рН 4 растворами гидроксида натрия либо соляной кислоты, прибавляя их по каплям из флакона-капельницы либо используя пипетку полимерную (если рН<4 – используйте раствор гидроксида натрия, если рН>4 – используйте раствор соляной кислоты).
4.
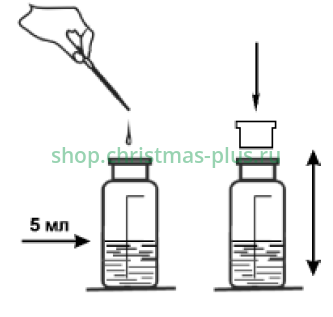
Добавьте в калиброванную мерную склянку с анализируемой водой раствор ортанилового К до метки «5 мл». Закройте склянку пробкой и перемешайте раствор.
5.
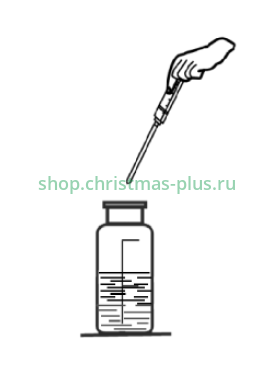
Соедините шприц-дозатор с пипеткой для титрования. С помощью шприца наберите в пипетку для титрования раствор хлорида бария. Постепенно, по каплям титруйте содержимое склянки раствором хлорида бария до появления неисчезающей (2–3 мин.) голубой окраски.
Примечание. Для чёткого определения точки эквивалентности при титровании, окраску титруемой пробы рекомендуется сравнивать с контрольной шкалой образцов окраски начала и окончания титрования.
 Соблюдайте осторожность: хлорид бария токсичен!
Соблюдайте осторожность: хлорид бария токсичен!
6.
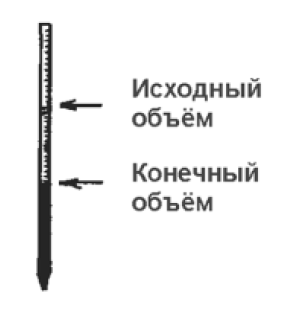
Определите объём раствора хлорида бария, израсходованного на титрование (V, мл):
V = Vо – Vк,
где Vо − исходный объем;
Vк − конечный объем.
7.
Рассчитайте концентрацию сульфатов (CС, мг/л) в анализируемой воде по формуле:
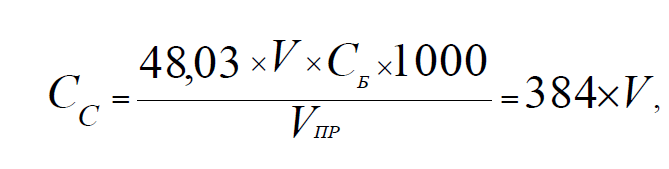
где 48,03 — молярная масса эквивалента сульфат-иона, г/моль;
V — объём раствора хлорида бария, израсходованного на титрование, мл;
СБ — концентрация раствора хлорида бария, используемого для титрования, 0,02 моль/л экв.;
1000 — коэффициент пересчёта единиц измерений из граммов в миллиграммы;
VПР — объём пробы, взятой для титрования, 2,5 мл.
Примечание. При разбавлении пробы концентрацию сульфат-ионов рассчитывайте по формуле:
CC = 384 × V × n,
где n – коэффициент разбавления.
Пример расчёта.
1. На титрование 2,5 мл анализируемой воды израсходовано 0,5 мл раствора хлорида бария. Рассчитываем концентрацию сульфат-иона в воде:
Концентрация сульфат-ионов в анализируемой воде составляет 192 мг/л.
2. Перед анализом проба воды была разбавлена в 3 раза (к 1 объёму пробы было добавлено 2 объёма дистиллированной воды). На титрование 2,5 мл разбавленной пробы израсходовано 0,7 мл раствора хлорида бария. Рассчитываем концентрацию сульфат-иона в воде:
Концентрация сульфат-иона в анализируемой воде составляет 806 мг/л.
Зафиксируйте результаты экспериментов в тетради.
Для консультации и по вопросам приобретения просьба обращаться:
voda@christmas-plus.ru
8 (800) 302-92-25 (звонок по РФ бесплатный)
8 (812) 575-54-07, 575-55-43
Подписывайтесь на наш канал в Ютюбе!
Вы всегда будете в курсе наших последних новостей и сможете наглядно познакомиться с нашей продукцией.
Вступительная информация
Сульфаты широко присутствуют во всех поверхностных водах. Главными источниками сульфатов в поверхностных водах являются процессы химического выветривания и растворения серосодержащих минералов, в основном гипса, а также окисления сульфидов и серы:
2FeS2 + 7O2 + 2H2O = 2FeSO4 + 2H2SO4;
2S + 3O2 + 2H2O = 2H2SO4.
Значительные количества сульфатов поступают в водоемы в процессе отмирания организмов, окисления наземных и водных веществ растительного и животного происхождения и с подземным стоком.2S + 3O2 + 2H2O = 2H2SO4.
Ионная форма SO42- характерна только для маломинерализованных вод. При увеличении минерализации сульфатные ионы склонны к образованию устойчивых ассоциированных нейтральных пар типа CaSO4, MgSO4.
Концентрация сульфата в природной воде изменяется в широких пределах. В речных водах и в водах пресных озер содержание сульфатов часто колеблется от 5-10 до 60 мг/дм3, в дождевых водах – от 1 до 10 мг/дм3. В подземных водах содержание сульфатов может достигать значительно больших величин.
Концентрация сульфатов в поверхностных водах подвержена заметным сезонным колебаниям и обычно коррелирует с изменением общей минерализации воды. Заметное влияние оказывают окислительно-восстановительные процессы, биологическая обстановка в водном объекте и хозяйственная деятельность человека.
Повышенное содержание сульфатов ухудшает органолептические свойства воды и оказывает физиологическое воздействие на организм человека. ПДК сульфатов в воде водоемов хозяйственно-питьевого назначения составляет 500 мг/дм3, лимитирующий показатель вредности – органолептический.
Данная работа выполняется с помощью производимого ГК «Крисмас» тест-комплекта «Сульфаты» (далее – ТК «Сульфаты»).

Тест-комплект представляет собой удобный для переноски, транспортирования и хранения жесткий корпус-укладку, в который компактно размещены необходимые средства измерения, готовые растворы и реагенты, посуда и оборудование, документация.
Тест-комплект «Сульфаты» максимально прост и удобен в использовании, успешно используется при выполнении проектных и учебно-исследовательских работ в курсах химии, биологии, факультативно в экологии, а также в специализированных образовательных организациях при изучении методов и средств водно-химического анализа.
Основное оборудование из состава ТК «Сульфаты»:
- лабораторная посуда и материалы (воронка полимерная, ложка мерная, пипетка полимерная на 1 мл и 3 мл, пипетка градуированная для титрования с соединительной трубкой и шприцем-дозатором, калиброванная мерная склянка с метками и пробкой, фильтры бумажные, бумага индикаторная универсальная);
- готовые реагенты (катионит КУ-2-8чС, раствор гидроксида натрия (0,1 моль/л), раствор кислоты соляной (0,1 моль/л), раствор хлорида бария (0,02 моль/л экв.), раствор индикатора ортанилового К в этаноле);
- контрольная шкала образцов окраски начала и окончания титрования.
Подробнее с алгоритмом приготовления почвенной вытяжки см. в работе 16 в изданном ГК «Крисмас» «Экологическом практикуме: Учебном пособии с комплектом карт-инструкций» / Под ред. к.х.н. А.Г. Муравьёва. – Изд. 7-е, перераб. – СПб.: Крисмас+, 2020. – 176 с.: ил.
Примечание. Экологический практикум входит в состав многих изделий, производимых и поставляемых ГК «Крисмас» – например, в класс-комплект-лабораторию ЭХБ, а также поставляется ГК «Крисмас» по отдельному заказу.
Ход работы
1.

Ополосните калиброванную мерную склянку несколько раз анализируемой водой. Поместите в склянку 2,5 мл пробы воды и, используя мерную ложку, внесите примерно 0,2 г катионита (0,2 г катионита помещается в мерной ложке без горки).
2.

Закройте склянку пробкой. Содержимое склянки встряхивайте в течение 3 мин.
3.

Доведите рН пробы по универсальной индикаторной бумаге до рН 4 растворами гидроксида натрия либо соляной кислоты, прибавляя их по каплям из флакона-капельницы либо используя пипетку полимерную (если рН<4 – используйте раствор гидроксида натрия, если рН>4 – используйте раствор соляной кислоты).
4.

Добавьте в калиброванную мерную склянку с анализируемой водой раствор ортанилового К до метки «5 мл». Закройте склянку пробкой и перемешайте раствор.
5.

Соедините шприц-дозатор с пипеткой для титрования. С помощью шприца наберите в пипетку для титрования раствор хлорида бария. Постепенно, по каплям титруйте содержимое склянки раствором хлорида бария до появления неисчезающей (2–3 мин.) голубой окраски.
Примечание. Для чёткого определения точки эквивалентности при титровании, окраску титруемой пробы рекомендуется сравнивать с контрольной шкалой образцов окраски начала и окончания титрования.
 Соблюдайте осторожность: хлорид бария токсичен!
Соблюдайте осторожность: хлорид бария токсичен!6.

Определите объём раствора хлорида бария, израсходованного на титрование (V, мл):
V = Vо – Vк,
где Vо − исходный объем;
Vк − конечный объем.
7.
Рассчитайте концентрацию сульфатов (CС, мг/л) в анализируемой воде по формуле:
где 48,03 — молярная масса эквивалента сульфат-иона, г/моль;
V — объём раствора хлорида бария, израсходованного на титрование, мл;
СБ — концентрация раствора хлорида бария, используемого для титрования, 0,02 моль/л экв.;
1000 — коэффициент пересчёта единиц измерений из граммов в миллиграммы;
VПР — объём пробы, взятой для титрования, 2,5 мл.
Примечание. При разбавлении пробы концентрацию сульфат-ионов рассчитывайте по формуле:
CC = 384 × V × n,
где n – коэффициент разбавления.
Пример расчёта.
1. На титрование 2,5 мл анализируемой воды израсходовано 0,5 мл раствора хлорида бария. Рассчитываем концентрацию сульфат-иона в воде:
CС = 384 × 0,5 = 192 мг/л.
Концентрация сульфат-ионов в анализируемой воде составляет 192 мг/л.
2. Перед анализом проба воды была разбавлена в 3 раза (к 1 объёму пробы было добавлено 2 объёма дистиллированной воды). На титрование 2,5 мл разбавленной пробы израсходовано 0,7 мл раствора хлорида бария. Рассчитываем концентрацию сульфат-иона в воде:
CС = 384 × 0,7 × 3 = 806 мг/л.
Концентрация сульфат-иона в анализируемой воде составляет 806 мг/л.
Зафиксируйте результаты экспериментов в тетради.
Для консультации и по вопросам приобретения просьба обращаться:
voda@christmas-plus.ru
8 (800) 302-92-25 (звонок по РФ бесплатный)
8 (812) 575-54-07, 575-55-43
Подписывайтесь на наш канал в Ютюбе!
Вы всегда будете в курсе наших последних новостей и сможете наглядно познакомиться с нашей продукцией.